








《《电解池》高三化学一轮复习化学反应原理PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为417.5 KB,总共有24页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 24页
- 417.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
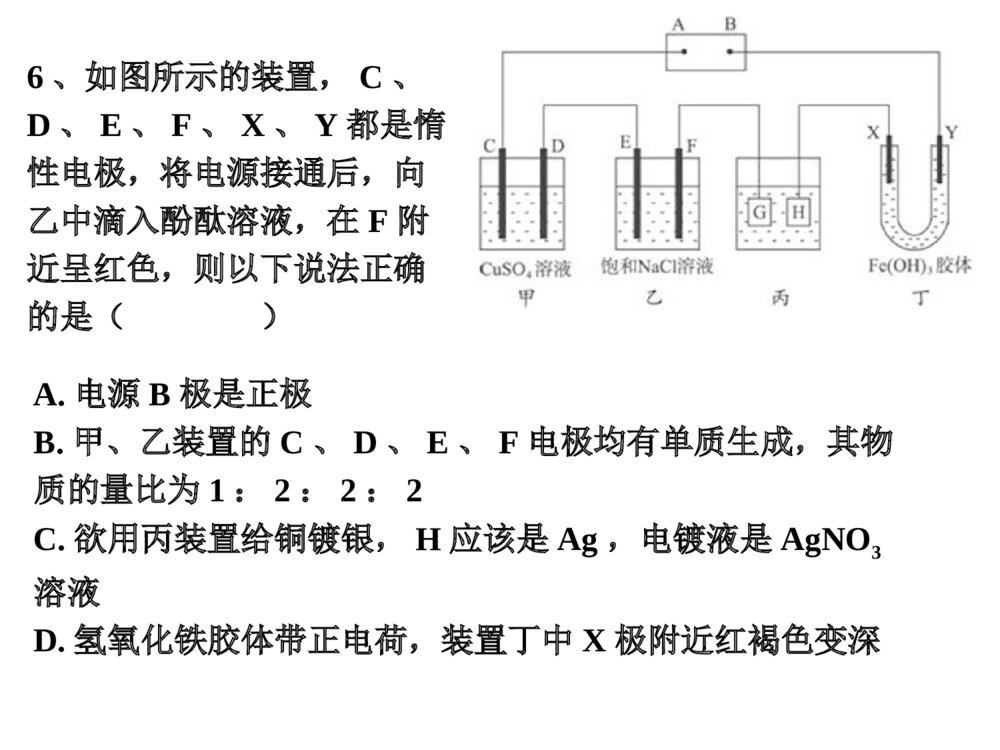
高三化学一轮复习化学反应原理电解池电解原理电解原理定义:在直流电的作用下,在两极上分别发生氧化反应和还原反应的过程叫电解。电解池:把电能转化为化学能的装置(1)形成电解池的条件①与外电源相连的两个电极②有电解质溶液或熔融态的电解质③形成闭合回路(2)电极名称(3)电极材料(4)离子、电子移动方向放电:阳离子得电子或阴离子失电子的过程①阴极:阳离子放电Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(中性)>Al3+>Mg2+>Na+>Ca2+>K+②阳极:活泼电极(Ag以前),电极失电子惰性电极(Pt、Au、石墨),阴离子放电S2->I->Br->Cl->OH->含氧酸根>F-用惰性电极电解各类物质用惰性电极电解各类物质(1)电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液①实质是电解水②电解后溶质的质量分数增大,加水恢复③pH值三种变化(2)电解无氧酸(除HF),不活泼金属无氧酸盐溶液,①实质是电解电解质本身,②电解后溶质的质量分数减小,加溶质恢复③pH值变化(3)电解不活泼金属的含氧酸盐溶液①实质是电解水和电解质②电解后溶质的质量分数减小,若要恢复原来,需加入一定量金属氧化物③pH值减小(4)电解活泼金属无氧酸盐溶液①实质是电解水和电解质②电解后溶质的质量分数减小,若要恢复原来,需通入一定量的HX③pH值增大(5)电解熔融态的离子化合物1、从H+、Cu2+、Na+、SO42-、Cl-五种离子中选择适当的离子组成电解质,使之符合下列要求。(1)以石墨为电极,电解时电解质质量减小,水量不变,应选用的电解质是。(2)以石墨棒为电极。电解时电解质质量不变,水量减少,应选用的电解质是。(3)以石墨棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是。2、如图为直流电源电解稀Na2SO4水溶液的装置,通电后,在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是()A.逸出气体的体积:a电极的小于b电极的B.电极逸出无味气体,另一电极逸出刺激性气味气体C.a电极附近呈红色,b电极附近呈蓝色D.a电极附近呈蓝色,b电极附近呈红色3、某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1,用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列实验现象不正确的是()A.阴极自始至终只析出H2B.阳极先析出Cl2,后析出O2C.电解最后阶段为电解水D.溶液pH不断增大,最后为74、在水中加等物质的量AgNO3,NaCl,Ba(NO3)2、K2SO4混合均匀,取溶液,用惰性电极电解,片刻后在两个极区析出的氧化产物与还原产物的物质的质量之比为()A.35.5:108B.1:2C.108:35.5D.8:15、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol碱式碳酸铜[Cu2(OH)2CO3]后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),则电解过程中共转移电子的物质的量是()A.0.8molB.0.6molC.0.5molD.0.4mol6、如图所示的装置,C、D、E、F、X、Y都是惰性电极,将电源接通后,向乙中滴入酚酞溶液,在F附近呈红色,则以下说法正确的是()A.电源B极是正极B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液D.氢氧化铁胶体带正电荷,装置丁中X极附近红褐色变深电解原理的应用电解原理的应用待镀制品铜片1、电镀①电极:阳极——镀层金属阴极——待镀金属制品②电镀液:含有镀层金属离子的电解质溶液。③电解质溶液:溶液中CuSO4的浓度保持不变。硫酸铜溶液2、电解精炼粗铜:含杂质(Zn、Ni、Ag、Au等)阴极:ZnFeNiCuAgAuZn-2e-=Zn2+Fe-2e-=Fe2+Ni-2e-=Ni2+Cu-2e-=Cu2+纯铜粗铜硫酸铜溶液阳极泥阳极:Cu2++2e-=Cu问:电解完后,CuSO4溶液的浓度有何变化?稍有减小7、金属镍有广泛的用途,粗镍中含有少量的Fe、Zn、Cu、Pt等杂质(已知:氧化性Fe2+<Ni2+<Cu2+),用电解法制备高纯度的镍,下列叙述中正确的是()A.阳极发生还原反应,其电极反应式:Ni2++2e-=NiB.电解过程中,阳极质量的减少与阴极质量的增加相等C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中只有Cu和Pt电解饱和食盐水电解饱和食盐水+-淡盐水NaOH溶液精制饱和NaCl溶液H2O(含少量NaOH)H2Cl2Cl-OH-Na+H+阳离子交换膜阳极室阴极室阳极金属钛网阴极碳钢网a.防止氢气和氯气混合而引起爆炸b.避免氯气和氢氧化钠反应,而影响强氧化钠的产量8、氯碱工业是一种高耗能产业,一种将燃烧电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )A.X为H2,Y为Cl2B.A池为电解池,且m<nC.B池为燃料电池,且a>bD.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度活泼金属的制备活泼金属的制备特别活泼的金属钠、镁、铝等只能通过电解的方法制取。熔融的Al2O3Al石墨阳极:阴极:6O2-—12e-=3O24Al3++12e-=4Al2Al2O3=4Al+3O2↑通电熔融思考:1、为什么要用冰晶石?在阳极要及时补充炭块?为什么不电解熔融的AlCl3?2、工业上制金属镁是电解氧化镁还是电解氯化镁还是氯化镁的水溶液?原电池与电解池的比较及判断原电池与电解池的比较及判断1、池型的判断(1)有外加电源为电解池或电镀池(2)无外加电源为原电池(3)多池组合,一极能与电解液反应的为原电池1、写出下列装置的电极反应,并判断A、B、C溶液pH值的变化。2、用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示,下列说法中,正确的是()A.若a极是铜,b极为铁时,当电池消耗1.6gO2,b极上析出6.4g铜B.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量D.若a、b两极均是石墨时,b极反应为4OH--4e-=O2↑+2H2O3、如图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是()A.P是电源的正极B.F极上发生的反应为:4OH--4e-=2H2O+O2↑C.电解时,甲、乙、丙三池中,除了E、F两极外,其他电极均参加反应D.通电后,甲池溶液的pH减小,而乙、丙两池溶液的pH不变牺牲阳极的阴极保护法(利用原电池原理)此法常用于保护海轮外壳及石油管道等外加直流电的阴极保护法(利用电解池原理)4、下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列是说法正确的是()A.X是正极,Y是负极B.X是负极,Y是正极C.CuSO4溶液的pH逐渐减小D.CuSO4溶液的pH值不变请举例:指出电极材料、电源正负、电解质1、a极变细,b极变粗:2、a极变细,b极有气泡:3、a极变粗,b极有气泡:4、a极有气泡,b极有气泡,且气体体积比为2:15、a极有气泡,b极有气泡,阴极加酚酞变红原电池电解池电源两极材料两极判断两极反应反应原理能量转化电子移动情况离子运动情况导体、活泼性有差异直流电源无导体即可看本身活泼性看与电源的连接方式负-氧化正-还原阳-氧化阴-还原自发的氧化还原反应不自发的氧化还原反应化学能-电能电能-化学能负极-外电路-正极负极-阴极阳极-正极阳离子-正极阴离子-负极阳离子-阴极阴离子-阳极



















